Cum de a găsi formula empirică


- Un compus, format din 40,92% carbon; 4,58% hidrogen și 54,5% oxigen, va avea formula empirică C3 H4 O3 (exemplu de modul de a localiza efectul Faraday al acestui compus va fi considerat în a doua parte).




Să știe cum să găsească raportul atomic. Lucrul cu o conexiune, veți fi obținut mai mult de un gram-atom. După ce a constatat toate atomii dvs. gram de conectare, uita-te la ei. În scopul de a găsi un raport atomic, va trebui să aleagă cea mai mică valoare a gram-atom, pe care le-ați calculat. Apoi, va fi necesar să se împartă toți atomii gram per atom gram mai mic. De exemplu:
- Să presupunem că lucrați cu un compus care conține trei gram-atom: 1,5; 2 și 2.5. Cel mai mic dintre aceste numere - 1.5. Prin urmare, pentru a găsi raportul de atomi, trebuie să împartă toate numerele de 1,5 și a pus între ele un semn al relației :.
- 1.5 / 1.5 = 1. 2 / 1,5 = 1,33. 2.5 / 1.5 = 1.66. Prin urmare, raportul atomic egal cu 1. 1.33. 1.66.
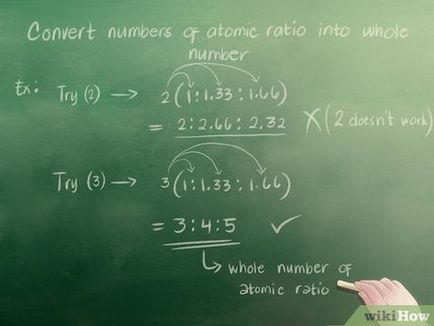
- Încercați 2. înmulțiți numărul de raport atomic (1, 1,33 și 1,66) de 2. Veți obține 2, 2,66 și 3,32. Acesta nu este un număr întreg, astfel încât 2 nu este adecvată.
- 3. Dacă încercați să multiplice 1, 1,33 și 1,66 la 3, veți obține 3, 4 și 5, respectiv. Prin urmare, raportul atomic de numere întregi are forma 3. 4. 5.
- X3 Y4 Z5