Gradul de oxidare - care este modul de a determina valoarea gradului de oxidare a elementelor
Un astfel de subiect școală cum ar fi chimia provoacă numeroase dificultăți în majoritatea studenților de astăzi, foarte puțini oameni ar putea determina gradul de oxidare în compușii. Cea mai mare dificultate la copiii de școală care studiază chimia anorganică, adică, elevii din ciclul primar (8-9 clasele). neînțelegere obiect conduce la displace elevilor la subiect.

Ce subiecte curs de chimie oferă studenților cel mai greu?
În cadrul noului program în cadrul disciplinei „Chimie“ școală de bază include mai multe teme majore: tabelul periodic al elementelor D. I. Mendeleeva, clase de substanțe anorganice, schimb de ioni. elevii de clasa cea mai grea dat determina gradul de oxidare a oxizilor.
reguli de plasare
Mai întâi de toți studenții ar trebui să fie conștienți de faptul că oxizii de doua elemente sunt compuși complecși, în care compoziția de oxigen inclus. Un compus binar condiție care aparține clasei de oxizi este oxigen într-un al doilea locatie compus dat.
Se calculează astfel de indice în orice clasă dată de formule se obține numai în cazul în care studentul are un algoritm specific.
Algoritmul pentru oxizii acizi
Pentru a începe, observăm că gradul de oxidare este o expresie numerică a valența elementelor. oxizii acizi sunt formate cu metale sau nemetale valența patru la șapte, un al doilea este necesară în astfel de oxizi este oxigen.
Oxizii de valență de oxigen corespunde întotdeauna două, poate fi stabili în funcție de elementele din tabelul periodic D. I. Mendeleeva. Acesta este un nemetal tipic ca oxigen, în timp ce în grupa 6 din tabelul periodic al subgrupului principal, acceptă doi electroni, pentru a finaliza complet nivelul de energie exterioară. Nemetale în compușii de oxigen prezintă adesea cea mai mare valența care corespunde numărului grupului însuși. Este important să se reamintească faptul că gradul de oxidare a elementelor chimice este un indicator presupunând un număr pozitiv (negativ).
picioare metaloid la începutul unei formule are o stare de oxidare pozitivă. oxizi nemetalici în oxigen stabil, -2 său de refracție. Pentru a verifica corectitudinea alinierii valorilor din oxizi de acid trebuie să multiplice toate numerele pe care le pune pe indicii elementului particular. Calculele sunt considerate valabile dacă se obține suma totală a tuturor argumentelor pro și contra ale setului de 0 grade.

Prepararea formulelor din doua elemente
Gradul de oxidare a elementelor atomice are o șansă de a crea și înregistra un compus din două elemente. La crearea unei formule de pornire ambele simboluri in prescris, cu atenție a doua da oxigen. Pe partea de sus a fiecăreia dintre mărcile înregistrate valoarea prescrisă a gradelor de oxidare, atunci există între numere este numărul care va fi fără nici un divizibil în mod egal de ambele numere. Indicatorul trebuie împărțit în mod individual prin valoarea numerică a gradului de oxidare pentru a obține indicii pentru prima și a doua componente ale materialului din două elemente. stare de oxidare mai mare este numeric egal cu valoarea mai mare de valență nemetal tipic este identic cu numărul de grup, în care PS este un metaloid.
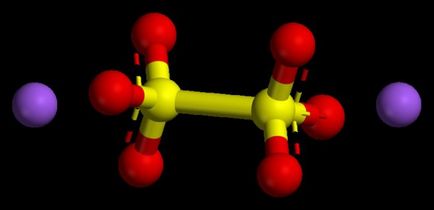
Performanțele algoritmului valori numerice în oxizi de bază
Astfel de compuși sunt considerați oxizi metalici tipice. Ele sunt în toți compușii au avut o rată a stării de oxidare a nu mai mult de una sau două. Pentru a înțelege ce va fi gradul de oxidare a metalului, este posibil să se profite de sistemul periodic. În metale principalele subgrupe ale primului grup, această opțiune este întotdeauna constantă, este similar cu numărul de grup, care este unul.
Fier subgrupă principal al doilea grup sunt de asemenea caracterizate printr-o stare de oxidare stabilă 2 numeric. Gradul de oxidare în cantitate de oxizi în vederea indicilor acestora (numerele) trebuie să dea la zero, deoarece substanța chimică este considerată o moleculă neutră, lipsită de o particulă de încărcare.
Alinierea oxidare în acizi conținând oxigen
Acizii sunt substanțe complexe compuse din unul sau mai mulți atomi de hidrogen, care sunt asociate cu unele reziduuri de acid. Având în vedere că gradul de oxidare este o ținte numerice de calcul a acestora necesită anumite abilități matematice. Un astfel de indicator la hidrogen (proton) întotdeauna stabil în acizi, este +1. Mai departe este posibil să se indice gradul de oxidare a ionului negativ de oxigen, este de asemenea stabilă, -2.
Numai după acești pași, este posibil să se calculeze gradul de oxidare a componentei centrale a formulei. Ca probă specifică ia în considerare elementele care determină gradul de oxidare în acid sulfuric, H2SO4. Având în vedere că în molecula substanței complexe conține doi protoni de hidrogen, 4 atomi de oxigen, obținem o expresie a formei + 2 + X 8 = 0. Pentru a sumei formate zero y este gradul de oxidare sulf 6
Alinierea oxidării în săruri
Sărurile sunt compuși complecși care constau din ioni metalici și unul sau mai mulți anioni. Metode de determinare a gradului de oxidare a fiecăreia dintre componentele din sarea complexă este aceeași ca și în acizii conțin oxigen. Având în vedere că gradul de oxidare a elementelor - un indicator digital este important să se indice gradul de oxidare a metalului.
Dacă formarea sării metalul este în subgrupul principal, starea de oxidare este stabil, corespunzător numărului grupului este pozitiv. Dacă sarea conține un metal astfel subgrupele PS prezintă diferite valență, valența metalului poate determina pe restul de acid. Când gradul de oxidare a metalului care urmează să fie instalat, pus gradul de oxidare a oxigenului (-2), urmată de calcularea gradului de oxidare a corpului central prin utilizarea ecuației chimice.
Ca un exemplu, ia în considerare definiția stărilor de oxidare pentru elementele din azotatul de sodiu (sare normală). NaNO3. subgrupă Sol principal de metal grupa 1 este format, prin urmare, gradul de oxidare a sodiului este +1. La oxigen în stare de oxidare nitrat de -2. Pentru a determina valoarea numerică a oxidării egalează + 1 + X-6 = 0. Rezolvarea acestei ecuații, obținem că X trebuie să fie de 5, aceasta este gradul de oxidare a azotului.

Termeni-cheie în IAD
Există condiții speciale care sunt necesare pentru a învăța studenții pentru procesul de oxidare și de reducere.
Gradul de oxidare este capacitatea sa de a direcționa atașa la sine (pentru a da diferite) electroni de la unii dintre ionii sau atomi.
Oxidantul este considerat atomi neutri sau ioni în timpul reacției chimice se unește electroni.
Agentul de reducere va atomilor neîncărcați sau ioni care, în procesul de interacțiune chimică își pierd propriile electroni.
Procedeul de oxidare este reprezentat ca un impact de electroni.
Recuperarea este asociat cu adoptarea de electroni suplimentari atom sau ion neîncărcată.
proces Redox este caracterizat prin reacția, în cursul căreia se schimbă în mod necesar gradul de oxidare al unui atom. Această definiție ne permite să înțelegem cum este posibil să se determine dacă reacția ISI.

reguli elemntare OVR
Folosind acest algoritm, coeficienții pot fi aranjate în orice reacție chimică.
Mai întâi trebuie să plasați în fiecare stare de oxidare chimică. Rețineți că, în starea de oxidare simplă substanță de la zero, deoarece nu există nici o ieșire (conexiune) de particule negative. Termenii de plasare de oxidare în compuși binari și trei de elemente au fost examinate de noi mai sus.
Apoi, este necesar să se identifice acei atomi sau ioni, care au avut loc în timpul conversiei, oxidarea schimbat.
Înregistrate din partea stângă a ecuației este atomilor sau ionilor izolați, care au modificat gradul lor de oxidare. Este necesar pentru bilanț. De-a lungul elementele necesare pentru a indica valoarea lor.
scris în continuare acei atomi sau ioni, care sunt formate în timpul reacției, un semn + indică numărul de electroni atom acceptat, - numărul de particule negative, turnate. Dacă procesul de interacțiune sunt reduse starea de oxidare. Acest lucru înseamnă că electronii au fost luați atom (ion). Când gradul de oxidare atom (ion) de a dona electroni în timpul reacției.
Cel mai mic număr total luat pentru a împărți primul, apoi sa turnat în timpul electronilor obținuți coeficienți. numere de puncte sunt factorii stereochimice necesare.
Se determină oxidant, reducătorul, procesele care au loc în timpul reacției.
Pasul final va fi alinierea factorilor stereochimice în această reacție.
exemplu OVR
Să considerăm o aplicație practică a algoritmului într-o anumită reacție chimică.
Calculăm toate substanțele simple și complexe.
Deoarece Fe și Cu sunt substanțe simple starea lor de oxidare este 0. CuSO4, de Cu + 2, apoi 2 atomi de oxigen, sulf și la +6. In FeSO4: Fe + 2, prin urmare, pentru o O 2, calc S +6.
Sunt acum în căutarea pentru elementele care ar putea schimba cifrele, în situația noastră, acestea vor fi de Fe și Cu.
Deoarece valoarea după reacția din atomul de fier a fost de 2, 2 electroni a fost dat în reacție. Cupru indexurilor schimbat la 0 la 2, în consecință, cuprul a luat 2 electroni. Acum definim numărul de electroni primite, și un atom de fier turnat și cationi cuprice. În timpul conversiei luate de cationi doi electroni cupric același electron atom de fier dat.
În acest proces nu este relevant pentru a determina minimul multiplu comun, astfel cum a luat și având în vedere în perioada de conversie număr egal de electroni. Factorii stereochimice se va conforma, de asemenea, una. În reacția agentului reducător va prezenta proprietăți de fier, în timp ce acesta este oxidat. cupru cation bivalent este redus la cupru pur în reacție are cel mai înalt grad de oxidare.

procesul de aplicare
Formula grad de oxidare trebuie să fie cunoscut în fiecare clasă de elev 8-9, deoarece această problemă este inclusă în lucrarea OGE. Orice procese care au loc cu oxidare, reducerea simptomelor, joacă un rol important în viața noastră. Acestea sunt procese metabolice indispensabile în organismul uman.