Clorul și compușii săi
R-H + Cl2 = R-CI + HCI
3. Laboratorul pregătit efectul conc. H2 SO4 pentru cloruri:
H2 SO4 (conc.) + NaCl = 2HCl ↑ + NaHSO4 (cu încălzire ușoară)
H2 SO4 (conc.) + 2NaCI = 2HCl ↑ + Na2 SO4 (la încălzire foarte puternică)
HCl este foarte solubil în apă, atunci când pe. T în 1 L H2O este dizolvat
450 litri de gaz (dizolvare este însoțită de eliberarea de căldură considerabilă). Soluția saturată are o fracție de masă de HCl, egală cu 36-37%. Această soluție are un miros foarte ascuțit, sufocant.
HCl în molecula de apă este disociază aproape complet in ioni, adică. Soluție apoasă E. HCl este un acid puternic.
1. HCI dizolvat în apă prezintă o toate proprietățile acizilor comune cauzate de prezența ionilor H +
1. Toate oxoacizi clor și sărurile lor sunt oxidanți puternici.
2. Aproape toți compușii sunt descompuse la încălzire datorită intramoleculară oxido-reducere sau disproporționare.
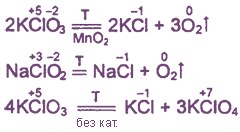
înălbitor
Percloric (pulbere de albire) var - un amestec de clorură de hipoclorit și calciu, are o albire și dezinfectare. Uneori, considerat ca un exemplu al unei sări mixte având în structura sa doi anioni de acizi simultan:
apă zhavelevoy
Apă și soluție de clorură de potasiu gapohlorita KCl + KClO + H2O