Peroxid de hidrogen - un
peroxid de hidrogen (apă oxigenată), H2O 2 - peroxizi simplu reprezentativi. lichid incolor, cu un gust „metalic“. infinit solubil în apă. alcool și eter. soluții apoase concentrate de exploziv. Peroxidul de hidrogen este un bun solvent. Apa este eliberată sub forma unui H2 cristalin instabil O2 • 2H2 O.
O moleculă de peroxid de hidrogen are următoarea structură:
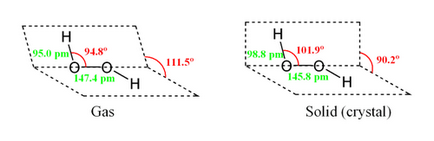
Din cauza asimetriei moleculei H2 O2 puternic polar (μ = 0,7 · 10 -29 m · Cl). Relativ mare vâscozitate de peroxid de hidrogen lichid cauzată de un sistem dezvoltat de legături de hidrogen. Deoarece atomii de oxigen au perechi de electroni nepuse, molecula H2 O2, de asemenea, este capabilă să formeze legături donor-acceptor.
chimice
Ambii atomi de oxigen sunt într-o stare de oxidare intermediară -1, care determină capacitatea de a acționa în calitate de peroxizi ca oxidanți și reductori. Cel mai caracteristic dintre ele oxidante proprietăți:
Prin reacția cu puternice acționează peroxid de hidrogen oxidanți ca reducător, fiind oxidat la oxigen:
Hidrogen molecula de peroxid foarte polar, care dă naștere la legături de hidrogen între molecule. Comunicare O-O este instabil, deci H2 O2 - compus instabil este ușor de descompus. De asemenea, aceasta poate contribui la prezența ionilor metalici de tranziție. În soluții diluate de peroxid de hidrogen este, de asemenea, nu este stabilă și disproporționare spontană la O2 și H2O Reacția este catalizată de disproporționare a ionilor metalici de tranziție, unele proteine:
Cu toate acestea, foarte pur peroxid de hidrogen stabil.
Peroxidul de hidrogen prezintă proprietăți slab acide (K = 1,4 · 10 -12), și, prin urmare, disociază în două etape:
Acțiunea soluției concentrate H2 O2 pentru mai mulți hidroxizi, în multe cazuri, se pot distinge peroxizi metalici, care pot fi considerate ca o sare de peroxid de hidrogen (Li2 O2 MgO2, etc ...):
Peroxidul de hidrogen poate fi atât de oxidare și de reducere a proprietăților. De exemplu, prin reacția cu oxid de argint agent reducător este:
În reacția cu compusul nitrit de potasiu comburant este:
grupă Peroxidul [-O-O-] face parte din mai multe substanțe. Astfel de substanțe sunt denumite peroxizi sau compuși peroxi. Acestea includ peroxizi metalici (Na2 O2. BaO2 și colab.). Acizii care conțin grupa de peroxid, numit peracizilor, de exemplu, peroksomonofosfornaya H3 PO5 și peroksidisernaya acidului H2 S2 O8.
proprietăţile redox
Peroxid de hidrogen oxidant are. și reducerea proprietăților. Se oxidează nitriți în nitrat. comunicatelor de iod din ioduri de metale, despică compuși nesaturați în locul legăturilor duble. Peroxidul de hidrogen restabilește săruri de aur și argint. și oxigen în reacție cu o soluție apoasă de permanganat de potasiu în mediu acid.
La restaurarea H2 O2 format H2O sau OH, de exemplu:
Sub acțiunea oxidanților puternici exponatelor H2 O2 reducerea proprietăților, eliberând oxigen liber:
reacția KMnO4 cu H2 O2 este utilizat în analiza chimică pentru determinarea H2 O2:
Oxidarea compușilor organici cu peroxid de hidrogen (de exemplu, sulfurile și tioli) este efectuată în mod avantajos în mediu de acid acetic.
proprietăți biologice
peroxid de hidrogen se referă la forme reactive ale oxigenului și la formarea crescute in celula provoaca stres oxidativ. Unele enzime. de exemplu, glucoza-oxidaza. format în timpul reacției redox de peroxid de hidrogen care poate juca un rol protector ca agent bactericid. În celulele de mamifere, nu există enzime. ceea ce ar reduce oxigenul la peroxid de hidrogen. Cu toate acestea, mai multe sisteme de enzime (xantin oxidaza. NAD (P) H-oxidaza, ciclooxigenaza etc.) Producerea superoxid. care în mod spontan sau prin acțiunea superoxid dismutaza este transformată în peroxid de hidrogen.
Peroxidul de hidrogen este preparat în industrie pentru reacțiile care implică compuși organici, în particular oxidarea catalitică de alcool izopropilic:
Valoroase subprodus al acestei reacții este acetona.
La scară industrială, peroxid de hidrogen este produs prin electroliza acidului sulfuric, care se formează în timpul acidul persulfuric și apoi descompunerea acesteia din urmă la peroxid și acid sulfuric.
În condiții de laborator, folosind o reacție pentru a produce peroxid de hidrogen:
Concentrarea și purificarea de peroxid de hidrogen se efectuează distilarea atentă.
cerere

soluție de apă oxigenată 3%
Datorită proprietăților sale oxidante puternice de peroxid de hidrogen au descoperit o largă utilizare în casă și în industrie, în cazul în care este utilizat, cum ar fi înălbitor în fabricarea textilelor și la fabricarea hârtiei. Este folosit ca propulsor - ca oxidant sau ca un singur component (descompus pe catalizator). Este utilizat în chimia analitică. ca agent de expandare în producerea materialelor poroase, în producția de dezinfectanți și agenți de înălbire. In industrie, peroxid de hidrogen își găsește, de asemenea, utilizarea sa ca un catalizator, agentul de hidrogenare, cum ar fi un agent de epoxidare în epoxidarea olefinelor.
În timp ce soluțiile diluate de peroxid de hidrogen folosit pentru mici rani superficiale, studiile au arătat că această metodă de a asigura un efect de curățare și antiseptic și prelungește procesul de vindecare. [1] [2] Cu proprietăți bune de curățare, peroxid de hidrogen nu este de fapt accelerează vindecarea rănilor. concentrații relativ mari care asigură un efect antiseptic poate extinde, de asemenea, timp din cauza deteriorarea celulelor adiacente vindecarea ranilor. [3] Mai mult decât atât, peroxidul de hidrogen poate impiedica vindecarea si de a promova cicatrici din cauza fractura start-piele celule. [4] Cu toate acestea, ca mijloc de purificare de profil complex răni adânci, striuri septice, phlegmon. și alte răni purulente care au împiedicat reabilitarea, Perique hidrogenul rămâne drogul de alegere. Din moment ce nu are doar un efect antiseptic, dar produce cantități mari de spumă, prin reacția cu peroxidază enzimă. Care, la rândul său, vă permite să se înmoaie și separa țesutul din zonele necrotice, cheaguri de sânge, puroi, care vor fi spălate cu ușurință departe prin introducerea ulterioară în cavitatea unei soluții antiseptice rana. Fără a pre-tratament cu peroxid de hidrogen, soluție antiseptică nu poate șterge datele formațiuni patologice, determinând o creștere semnificativă a timpului vindecarea rănilor și poate agrava starea pacientului.
Peroxidul de hidrogen este de asemenea folosit pentru albirea parului [5] și albirea dinților [6]. dar în ambele cazuri, efectul se bazează pe oxidarea și, prin urmare, distrugerea țesutului, și, prin urmare, această utilizare (în special pentru dinți) nu este recomandată de către experți.
In industria alimentara soluțiile de peroxid de hidrogen folosite pentru a dezinfecta suprafețele echipamentelor de proces în contact direct cu produsele. În plus, întreprinderile de producere de produse lactate, sucuri, soluții de peroxid de hidrogen este utilizat pentru dezinfectarea pachetului ( „Tetra Pak“ tehnologie). Pentru aplicații tehnice de peroxid de hidrogen folosite în producerea echipamentelor electronice.
Locuinta este, de asemenea, utilizat pentru a îndepărta petele MnO2. preparat prin reacția permanganat „mangan“ obiecte de potasiu (datorită proprietăților sale oxidante).
Peroxidul de hidrogen în acvariu
Această secțiune lipsesc referințele bibliografice la sursele de informații.
soluție de apă oxigenată 3%, este utilizat pentru revitalizarea înecare pesti de acvariu, și pentru curățarea rezervoarelor si controlul florei nedorite și faunei din acvariu (Hydra, Planarians. Paraziți, alge, bacterii, etc.).
emitere
Disponibil sub formă de soluții apoase, concentrația standard a 1-6%, 30, 38, 50, 60, 85, 90 și 98%. soluție apoasă de apă oxigenată 30% stabilizat prin adăugarea de fosfat de sodiu este numit perhidrol.
utilizarea de periculoase
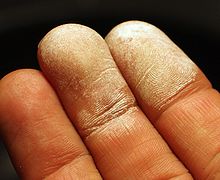
Pielea după expunerea la aceasta soluție 30% de peroxid de hidrogen.
In ciuda faptului ca peroxid de hidrogen nu este toxic. soluțiile concentrate în contact cu pielea, mucoasele și căile respiratorii provoca arsuri. În concentrații mari insuficient de peroxid de hidrogen pur poate fi exploziv. soluții concentrate ingerare dăunătoare. Cauze exprimate modificări distructive similare acțiunii alcaline. Doza letală de soluție de peroxid de hidrogen 30% (perhidrol) - 50-100 ml. [7]
literatură
Vezi ce „peroxid de hidrogen“ în alte dicționare:
Peroxidul de hidrogen - Peroxidul de hidrogen Sistematic Denumire comună Formulă chimică Peroxid de hidrogen ... Wikipedia
peroxid de hidrogen - peroxid de hidrogen general Sistematic Denumirea de hidrogen peroxid Formulă chimică ... Wikipedia
PEROXIDULUI - (peroxid de hidrogen), H2O2, lichid, B.P. 150,2shC. 30% hidrogen min perhidrol soluție. soluții apoase concentrate de peroxid de hidrogen sunt explozive. Peroxidul de hidrogen este folosit ca oxidant în propulsor în prepararea diferitelor ... ... Encyclopedia Modern
peroxid de hidrogen - (peroxid de hidrogen), H2O2, lichid, punct de fierbere 150,2 ° C 30% hidrogen min perhidrol soluție. soluții apoase concentrate de peroxid de hidrogen sunt explozive. Peroxidul de hidrogen este folosit ca oxidant în propulsor în prepararea diferitelor ... ... Ilustrat Dicționarul Enciclopedic
Peroxide - (fostă peroxid) substanță care conține peroxo O O (de exemplu, H2O2 peroxid de hidrogen, peroxid de sodiu, Na2O2). Peroxid eliberează oxigen ușor. se recomandă să se folosească termenul de compuși peroxizi anorganici, pentru ... ... Wikipedia
peroxid de Cesiu - nume tradiționale generale Denumirea sistematică peroxid de cesiu peroxid de cesiu Formula chimică Formula empirică Cs2O2 Cs2O2 ... Wikipedia
crom Peroxide (VI) - peroxid, crom (VI) CrO (O2) 2 sau CrO5, substanță albastră nu este izolat în formă pură. Este cunoscut în soluție sau sub formă de solvați cu solvenți organici. Nume sistematic ... Wikipedia
Peroxid de mercur - Denumirea sistematică generală a peroxidului denumirilor tradiționale de mercur peroxidul Formula mercur HgO2 chimice Proprietăți fizice Molar de masă ... Wikipedia
peroxid de zinc - sistemic general peroxid de zinc nume Denumirea tradițională Formula de zinc peroxid chimică ZnO2 Proprietăți fizice Stare (... Wikipedia