masă moleculară
Masele atomilor și moleculelor diferă în mod semnificativ. Ce valori le caracterizează confortabil? Cum pentru a determina numărul de atomi în orice organism macroscopică?
Greutatea moleculelor de apă. Greutățile moleculelor individuale și atomi sunt foarte mici. De exemplu, 1 g de apă a conținut 3,7 • 22 molecule octombrie. În consecință, masa unei molecule de apă (H2 0) este egal cu:
Masa același ordin sunt molecule de alte substanțe cu excepția moleculelor mari de substanțe organice; de exemplu, proteinele au o greutate de sute de mii de ori mai mare decât masa atomilor individuali. Dar încă greutatea lor la scară macroscopică (grame si kilograme) este extrem de mic.
Masă moleculară relativă. Deoarece greutatea moleculară este foarte mică, care nu este utilizat în calculul valorilor masei absolute ci relative. Prin greutate acord internațional al tuturor atomilor și moleculelor comparativ cu 1/12 din masa unui atom de carbon (așa-numita masă carbon scară atomică). molecular (sau atomică) raportul în greutate relativă a masei veschestvaMr numesc molecule (sau atom) m0 substanței 1/12 din masa m0C atom de carbon:
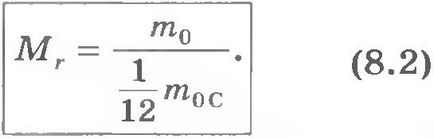
Masele atomice relative ale tuturor elementelor chimice măsurate cu precizie.
Adăugarea ponderile relative atomice ale elementelor care alcătuiesc substanța moleculei, se poate calcula o masă moleculară relativă a substanței. De exemplu, masa moleculară relativă de CO2 de dioxid de carbon este aproximativ egală cu 44, deoarece masa atomica relativa a carbonului este exact egală cu 12, și oxigen de aproximativ 16: 12 + 2 = 44 16 •.
Cantitatea de substanță și Avogadro constantă Cantitatea de substanță cea mai naturală pentru a măsura numărul de atomi sau molecule din organism. Dar numărul de molecule în orice organism macroscopică este atât de mare, încât calculele utilizate nu sunt numărul absolut de molecule, și numărul relativ.
Sistemul internațional de unități cantitate dintr-o substanță, exprimată în moli. Un mol - o cantitate de substanță care conține același număr de molecule sau atomi ca atomi de carbon conținut în masa de 0,012 kg.
Aceasta înseamnă că în 1 mol de orice substanță conține același număr de atomi sau molecule. Acesta este numărul de atomi desemnați numărul și numele lui Avogadro NA după savantul italian (XIX în.).
Pentru a determina nevoia constantă Avogadro de a găsi o masă de un atom de carbon. O estimare aproximativă a masei poate fi făcută așa cum sa făcut mai sus pentru masa unei molecule de apă (metode mai exacte se bazează pe abaterea de fascicule ionice câmp electromagnetic).
Pentru măsurarea greutății atomilor de carbon da :.
NA Avogadro constantă poate fi determinată prin împărțirea greutății carbonului luată într-o cantitate de un mol, față de greutatea atomului de carbon:
Desemnare mol -1 indică faptul că NA - numărul de atomi din 1 mol de orice substanță. Dacă, de exemplu, cantitatea de substanță. numărul de molecule din organism. Acest lucru arată că cantitatea unei substanțe este raportul dintre numărul N de molecule din corp la constanta lui Avogadro NA. .. Ie la numărul de molecule din 1 mol de substanță:
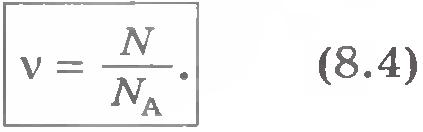
Imens valoare numerică Avogadro constantă arată cât de mică la scară microscopică, comparativ cu macroscopică. Corpul având cantitatea de substanță de 1 mol, ne este familiar dimensiuni macroscopice și greutatea de ordinul a câteva zeci de grame.
Masa molară. Împreună cu o greutate moleculară relativă dl în fizică și chimie sunt utilizate pe scară largă conceptul de masă moleculară. masa molara substanță M substanțe numite greutate luate într-o cantitate de 1 mol.
Conform acestei definiții, masa molară a unei substanțe este molecula de produs masa de pe constanta lui Avogadro:
m în masă orice cantitate de substanță este produsul dintre masa unei molecule de numărul de molecule din organism:
Înlocuirea NA și N în formula (8.4) prin expresiile cu formulele (8.5) și (8.6), obținem
Cantitatea de substanță egală cu masa substanței la masa molară. Aceasta este definiția cantității de substanță este dată în chimia manual.
Numărul de molecule de orice cantitate de substanță de masă m și masa molară M în conformitate cu ecuațiile (8.4) și (8.7) este:
Formulele (8.2), (8.4) și (8.5) dau definiția unei noi cantități fizice, cum ar fi masa moleculară relativă, numărul de substanțe și masa molară. Nu le pot obține, acestea ar trebui să fie ușor de reținut. Restul formulei de exemplu (8.7) și (8.8) poate fi derivată.
.
1. Care este masa moleculară relativă a apei?
2. Cât de multe molecule din cele două molecule de apă?
3. Poți dovedi că masa molară M este asociată cu un raport de greutate moleculară relativă M≈10 -3 Mr mol • kg -1
(În dovedirea necesară utilizarea formulei (8.5), (8.2), precum și masa de atomi de carbon și constanta lui Avogadro.)
G.Ya.Myakishev, B.B.Buhovtsev, N.N.Sotsky 10 Fizică clasa
Dacă aveți corecturi sau sugestii la această lecție, vă rugăm să ne contactați.
Dacă doriți să vedeți alte ajustări și sugestii pentru lecții, uita-te aici - Forumul Educațional.