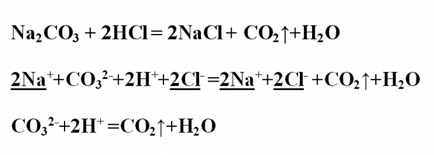Cum se scrie ecuațiile ionice
Înainte de a începe să scrieți ecuații ionice, trebuie să învețe câteva reguli. Insolubil în apă și substanță gazoasă malodissotsiiruyuschie (de exemplu, apă) în ioni nu se descompun, și, prin urmare, să le înregistreze în formă moleculară. De asemenea, aici sunt electroliți slabi, cum ar fi H2S, H2CO3, H2SO3, NH4OH. Solubilitatea compușilor pot fi găsite pe solubilitatea mesei, care este un material de referință permisă pe toate tipurile de control. Acolo sunt date toate taxele care sunt inerente în cationi și anioni. Pentru punerea în aplicare integrală a lucrării, atunci când scrieți moleculare, ioni și ionul completă ecuație prescurtată.
Exemplul № 1. Reacția de neutralizare între Write acid sulfuric și hidroxid de potasiu, considerăm că în ceea ce privește TED (teoria disocierii electrolitice). Vă rugăm să rețineți ecuația reacției în formă moleculară și aranja koeffitsienty.H2SO4 + 2KOH = K2SO4 + 2H2OProanaliziruyte substanță obținută asupra solubilității și disocierea acestora. Toți compușii sunt solubili în apă și, prin urmare, disociază în ioni. Singura excepție este apa, care nu se dezintegrează în ioni, prin urmare, să rămână în vide.Napishite ion ecuația completă moleculare, găsi aceleași ioni din stânga și din dreapta părți, și subliniază. Pentru a reduce aceeași ioni, cruce ih.2H + + SO4 2- + 2K + + 2OH- = 2K + + SO4 2- + 2H2OV rezultat va ionic ecuația abreviat: 2H + + 2OH- = 2H2OKoeffitsienty sub formă de perechi poate fi redusă: H + + OH- = H2O
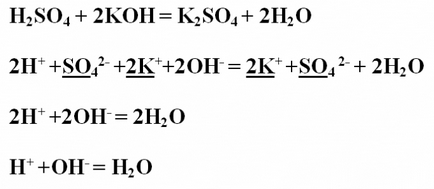
Exemplul № 2. reacția de schimb între clorură de cupru Scrierea și hidroxid de sodiu, consideră că, în ceea ce privește TED. Se înregistrează ecuația reacției în formă moleculară și aranjează coeficienții. Ca rezultat, hidroxidul de cupru care rezultă precipitat albastru. CuCl2 + 2NaOH = Cu (OH) 2 ↓ + 2NaClProanaliziruyte toate substanțele de pe solubilitatea lor în apă - totul solubil cu excepția hidroxid de cupru, care se disociază în ioni nu. Înregistrarea ionică ecuația completă, stresul și de a reduce aceeași ioni: Cu2 + + 2Cl- + 2Na + + 2OH- = Cu (OH) 2 ↓ + 2Na + + 2CI-ionice rămâne ecuația abreviat: Cu2 + + 2OH- = Cu (OH) 2 ↓
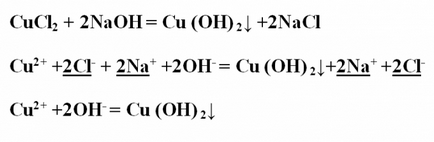
Exemplul № 3. Scrieþi reacția de schimb între carbonat de sodiu și acid clorhidric, consideră că, în ceea ce privește TED. Se înregistrează ecuația reacției în formă moleculară și aranjează coeficienții. Reacția rezultată produce clorură de sodiu și CO2 gazos eliberat (dioxid de carbon sau monoxid de carbon (IV)). Acesta este format prin descompunerea acidului carbonic slab descompunându oxid și apă. Na2CO3 + 2HCl = 2NaCI + CO2 ↑ + H2OProanaliziruyte toate substanțele de pe solubilitatea lor apoasă și disociere. Dioxidul de carbon părăsește sistemul sub formă de compus gazos, apa - este substanta malodissotsiiruyuschee. Toate celelalte substanțe se descompun în ioni. Înregistrarea ionică ecuația completă, stresul și de a reduce aceeași ioni: 2Na + + SO3 2- + 2H + + 2Cl- = 2Na + + 2Cl- + CO2 ↑ + H2OOstaetsya ionică ecuație abreviat: SO3 2- + 2H + = CO2 ↑ + H2O